A compra de equipamento também não lhe dá permissão para usá-lo em ambiente farmacêutico; qualificação e validação ainda estão em seu caminho. O principal objetivo delas não é impedir que você use seu equipamento ou aumentar seus custos, mas ajudá-lo a garantir uma qualidade consistente dos produtos finais.
Na Sensum, interagimos com diversas equipes de garantia de qualidade farmacêutica no tema de qualificação e validação, à medida que desenvolvemos e fornecemos soluções para inspeção visual automática de produtos finais, que precisam de uma supervisão mais próxima por garantia de qualidade do que por sistemas de controle de qualidade. Há mais de 15 anos vivenciamos diferentes cenários de qualificação, o que nos permitiu identificar diversas boas práticas. Nos parágrafos seguintes, você encontrará informações práticas sobre o processo de qualificação com algumas dicas úteis que podem ajudá-lo em qualquer projeto de qualificação.
Para começo de conversa: o que é validação e o que é qualificação?
A validação é um conceito mais amplo do que a qualificação e está relacionada a processos como o processo de fabricação. Ela pode ser explicada simplesmente como uma abordagem sistemática que verifica e ajuda os processos a terem resultados esperados e consistentes. A validação não envolve apenas equipamentos, mas também diversos sistemas complementares, softwares e pessoas que fazem parte do processo.
A validação divide-se em diversas atividades e uma delas é a qualificação, que está relacionada à introdução de sistemas no processo. A função da qualificação é garantir que um determinado sistema atenda aos requisitos regulatórios, aos padrões da indústria e ao desempenho esperado.
O (mal)falado modelo V
A extensão da qualificação depende da complexidade do equipamento. Por exemplo, a qualificação de um recipiente intermédio para granel deverá exigir menos esforço em comparação com um sistema de inspeção visual. Analisaremos a qualificação de um sistema informatizado configurado, que abrange todas as etapas típicas de qualificação. O procedimento de qualificação para o exemplo é apresentado no modelo V abaixo com duas fases: especificação e verificação.
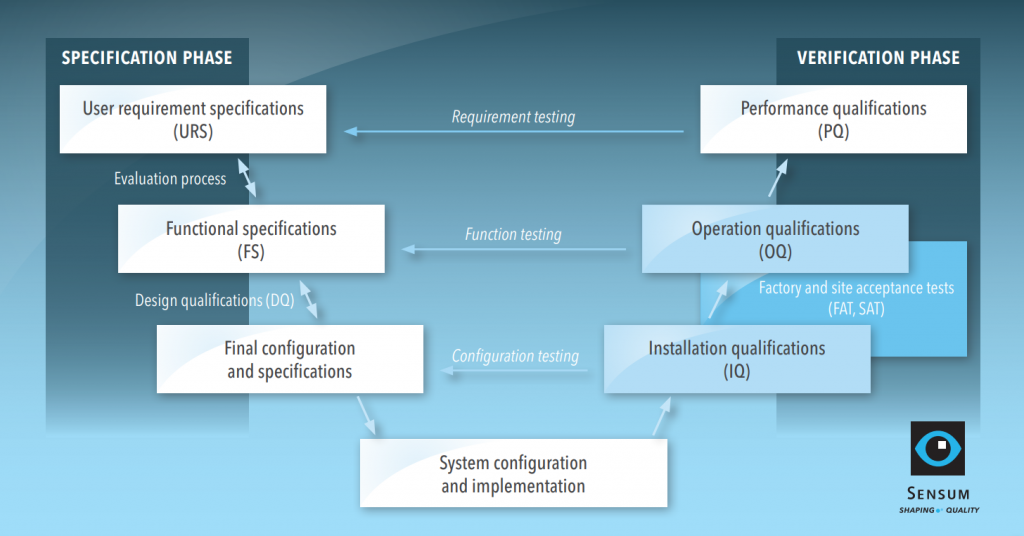
Fase de especificação: de URS a DQ
As especificações de requisitos do usuário (User Requirements Specifications – URS) são preparadas pelo usuário final que lista suas expectativas e requisitos para seu processo. O URS é um documento básico que agiliza todo o processo de qualificação.
Na Sensum, como fornecedor, encontramos muitos URSs. A maioria dos documentos URS tem muitos requisitos com mais de 20 páginas, mas os requisitos reais relevantes para o projeto específico são escritos em apenas um ou dois pontos curtos. Isso acontece porque as URS são elaborados a partir de um modelo ou de URSs de outro projeto sem modificações e correções críticas. As URSs têm impacto em todo o procedimento de qualificação e pegar atalhos aqui não ajuda. Algumas dicas para as URS:
• Remova requisitos gerais que não são aplicáveis. Esses requisitos provocarão discussões desnecessárias ou até mesmo ampliarão as qualificações.
• Não se esqueça de adicionar os dados importantes. Consulte seus especialistas em produção para que os requisitos cubram as necessidades reais do processo, como rendimento, qualidade de operação, eficiência, geração de resíduos, configurações da máquina, montagem de peças, tempos de inatividade, limpeza, calibração, manutenção, habilidades necessárias para usar a máquina, etc.
Depois que as URS são acordadas e aprovadas, elas normalmente são compartilhadas com vários fornecedores em potencial. Cada fornecedor responde às URS com uma cotação e vários documentos de especificação funcional (Functional Specification – FS), que são difíceis de ler e muitas vezes impossíveis de vincular a cada ponto das URS.
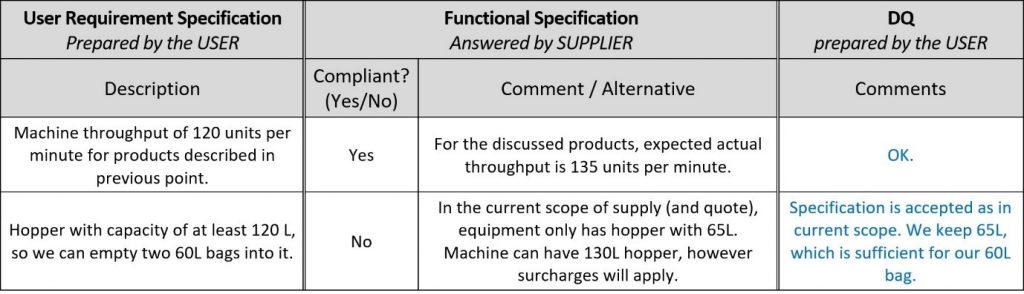
Para uma avaliação mais rápida das ofertas dos fornecedores, abra espaço no documento URS para seus comentários e dê à nova coluna o nome de “especificação funcional”, pois na verdade seus comentários são confirmações funcionais e descrições da máquina deles! Dessa forma, você pode evitar completamente a leitura dos documentos de projeto do fornecedor. Aqui está um exemplo:
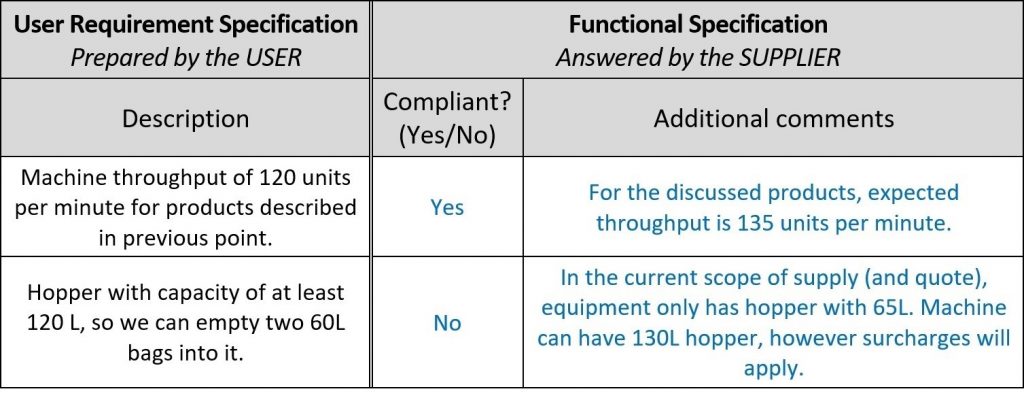
Depois que os fornecedores fornecerem seu feedback, é hora da qualificação do projeto (Design Qualification- DQ). Conforme mencionado na introdução, o escopo das qualificações depende da complexidade do sistema. Nesse exemplo, a DQ tem três etapas: avaliações de propostas, análise de riscos e configuração de testes, o que parece problemático com uma enorme quantidade de trabalho, mas com configuração adequada, é administrável.
Na primeira etapa da DQ, o usuário deve verificar se o fornecedor atende aos requisitos descritos nas URS. Não é preciso dizer que, se um fornecedor não puder atender a todos os requisitos, converse com ele e encontre soluções aceitáveis para os dois ou escolha um fornecedor/solução mais adequado. Se você anexou as URS à FS conforme proposto neste artigo, a maior parte da DQ pode ser feita respondendo aos comentários do fornecedor.
Basta fazer a DQ dentro do documento URS/FS justificando suas decisões como no exemplo abaixo.
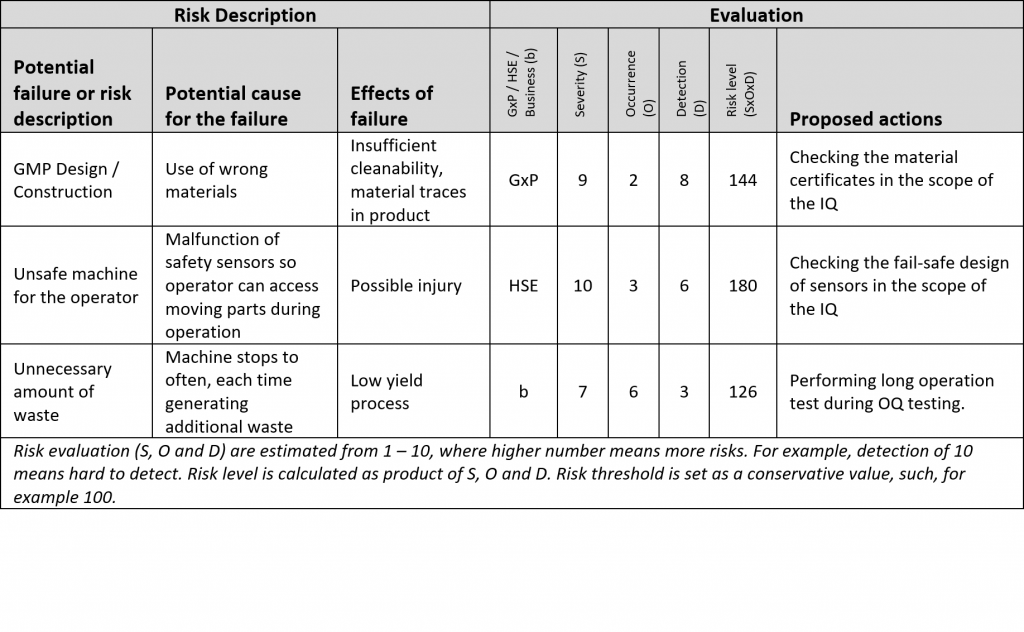
A segunda etapa da DQ é a análise de riscos. Ela é iniciada somente após a primeira etapa ser acordada entre o usuário e o fornecedor. O resultado da análise de riscos são pontos e especificações que precisam ser testados e abordados durante as qualificações.
A análise de riscos é uma tarefa difícil, especialmente se a tecnologia for nova para o usuário. Não tente fabricar um possível risco para cada ponto das URS. Use a experiência e o bom senso. Se os riscos forem muito difíceis de definir por algum motivo, o fornecedor poderá ajudá-lo com a análise de riscos. O fornecedor conhece a solução em profundidade melhor do que ninguém.
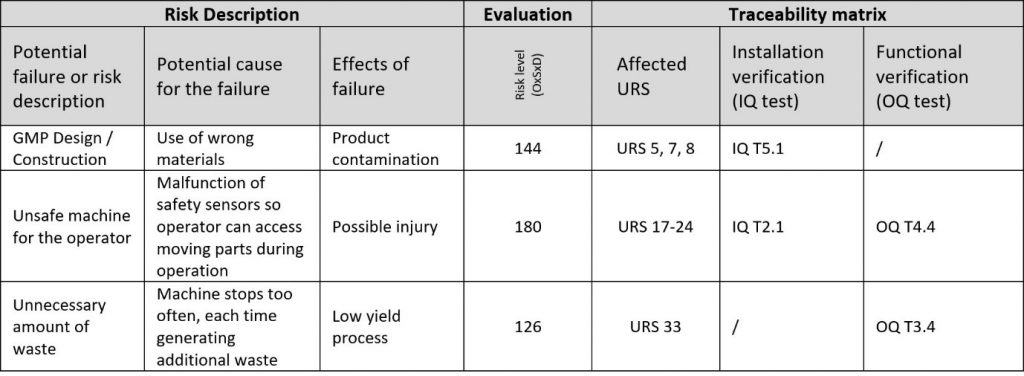
A última etapa da DQ é a criação de testes de qualificação para a fase de verificação do modelo V. Os testes devem verificar se o fornecedor está realmente fornecendo tudo conforme acordado e devem abordar qualquer risco que esteja acima do limite de risco.
O documento IQ/OQ do fornecedor incluirá testes para a maioria dos pontos e riscos exigidos. Dê uma olhada nesses testes antes de começar a configurar novos testes. Além disso, tente justificar requisitos e riscos gerais com funcionalidade para simplificar seus protocolos de qualificação e minimizar testes redundantes:
• Vamos assumir um risco: “Uma câmera no sistema de inspeção não está funcionando”. Não faça um teste especial para verificar se a câmera está instalada, conectada à energia e funcionando. Atribua o risco a um teste geral, como “inicialização da máquina”, que você fará de qualquer maneira, e justifique que você poderá ver imagens ao vivo na HMI após a inicialização e, portanto, o sistema possui uma câmera funcional.
• Vamos agora imaginar um requisito do usuário na trilha de auditoria: “Todas as ações na máquina devem ser registradas na trilha de auditoria”. Não faça um teste especial de “verificação da trilha de auditoria”. Tente atribuir o requisito a qualquer teste operacional, em que o relatório do lote com trilha de auditoria será verificado por quaisquer outros motivos.
O resultado final da DQ é a matriz de rastreabilidade, que vincula riscos e requisitos a testes.
As matrizes de rastreabilidade são conhecidas por muitas coisas. Economizar tempo da equipe do projeto não é uma dessas coisas. O desafio é tornar as conexões entre URS, riscos e testes claras e tão simples quanto possível. Por experiência, sempre haverá mais pontos das URS do que riscos em número. Por isso, atribua pontos das URS aos riscos e não o contrário. Alguns pontos das URS podem até não ser atribuídos, o que apenas indicará que os pontos das URS não atribuídos não são arriscados para o projeto.
Fase de verificação: finalmente, IQ, OQ e PQ
Quando a fase de especificações termina e o fornecedor está pronto para a instalação, inicia-se a fase de verificação. O usuário e o fornecedor seguirão os protocolos IQ/OQ e o usuário concluirá qualificações com PQ.
O usuário e o fornecedor devem concordar com o protocolo exato e o escopo dos testes durante a DQ para minimizar a realização de novos testes durante a qualificação, o que é arriscado para ambas as partes.
A IQ/OQ normalmente é feita duas vezes. Em primeiro lugar, isso é feito no fornecedor como parte dos testes de aceitação de fábrica (factory acceptance tests – FAT). Durante os FAT, quaisquer alterações no sistema devido a alterações de requisitos (ah, isso acontece com frequência) ou devido a possíveis desvios não são tão caras quanto mais tarde, quando o sistema está fora das instalações de fabricação.
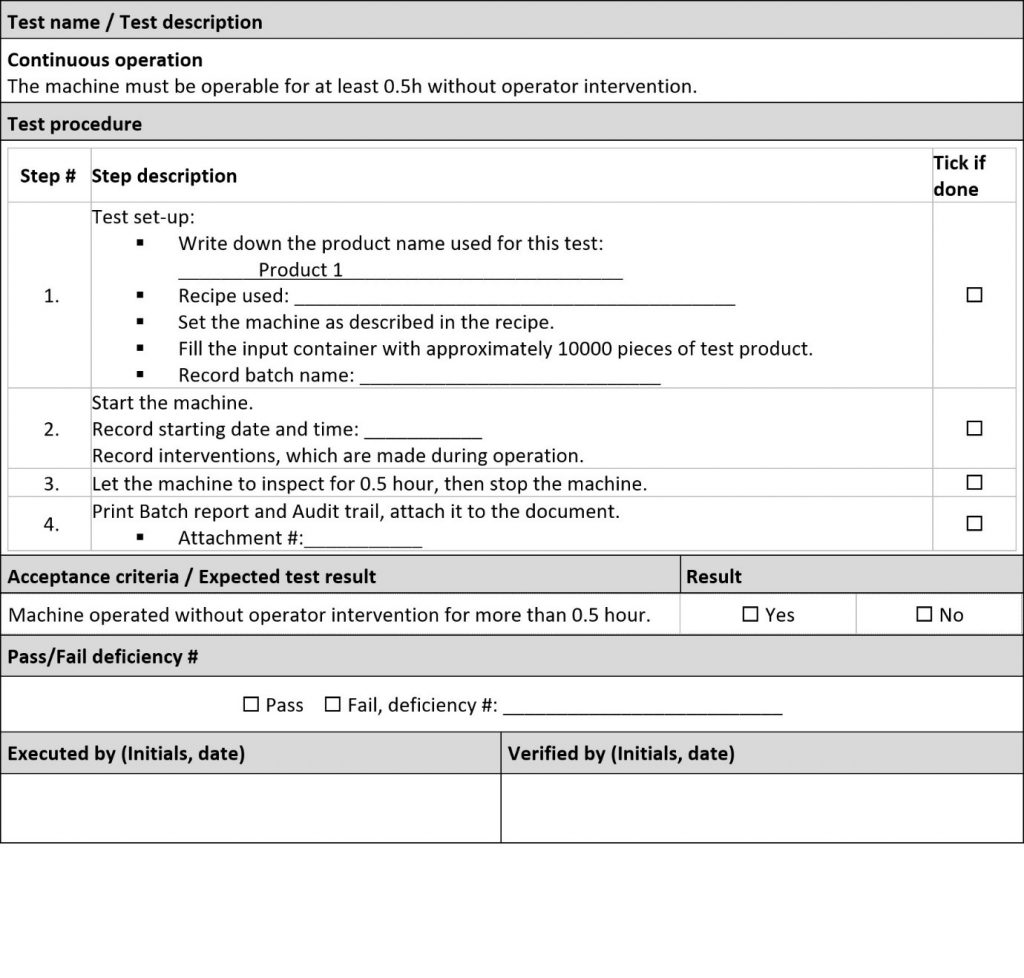
Os FAT geralmente são a primeira experiência do usuário com a máquina. Gaste seu tempo com OQ tanto quanto possível, porque a OQ consiste em testes nos quais a máquina está realizando seu trabalho. É difícil imaginar um desvio pior que um desvio de segurança ou funcional. No entanto, a IQ ainda é um pré-requisito para a OQ, então tente fazê-la o mais rápido possível, fazendo apenas o necessário e pulando mais testes administrativos com “N/A nos FAT” ou “Não é arriscado, deve ser testado nos SAT” para chegar à OQ o mais rápido possível.
Em segundo lugar, a IQ/OQ é repetida com os mesmos produtos após a instalação final no local do usuário como parte dos testes de aceitação no local (site acceptance tests – SAT).
Envie o usuário final (operadores da produção) para FAT/SAT. Se os operadores realizarem os testes, os FAT e os SAT tornam-se um treinamento muito eficiente ao mesmo tempo. Além disso, tente fazer com que os testes operacionais da OQ pareçam operações/processos reais. Os capítulos típicos incluídos na OQ são:
• Configuração de hardware e software antes de iniciar um lote
• Testes para alimentação/descarga
• Testes para operação de longo prazo, avaliação de desempenho, avaliação de geração de resíduos, verificações de rendimento
• Testes de tempo de inatividade: Testes de limpeza, testes de montagem/desmontagem
Experiências de OQ serão muito bem-vindas na preparação para a PQ.
A qualificação de desempenho (Performance Qualification – PQ) é realizada pelo usuário após SAT bem-sucedido. O usuário deverá ter preparado um procedimento operacional padrão (POP) e segui-lo durante a PQ. Os produtos fabricados/processados após uma PQ bem-sucedida já podem ser utilizados comercialmente.
O fornecedor pode ajudá-lo a otimizar seu POP, que será utilizado por muitos anos. A otimização e a modificação neste ponto inicial melhorarão a taxa de sucesso da PQ e melhorarão a taxa de sucesso de todas as execuções posteriores.
Apêndices
• Exemplo – IQ OQ para testes de aceitação de fábrica
• Exemplo – Modelo de matriz de avaliação de risco e rastreabilidade
• Exemplo – Especificações de requisitos do usuário (User Requirement Specifications – URS)
Este artigo foi publicado originalmente na Pharmaceutical Technology:
– https://www.pharmaceutical-technology.com/sponsored/pharmaceutical-qualification-and-validation/